Bestimmung der Fluoreszenzquantenausbeute
Die Fluoreszenzquantenausbeute (ηfl; engl. fluorescence quantum yield, QY) ist neben der spektralen Lage der Fluoreszenz eine wichtige optische Kenngröße eines Fluorophors. Außer der Größe des Extinktionskoeffizienten entscheidet insbesondere die Höhe der Quantenausbeute über die bei der Verwendung des Farbstoffs als Fluoreszenzmarker erhaltene Signalintensität: Im englischen Sprachgebrauch wird das Produkt aus Extinktionskoeffizient und Quantenausbeute deshalb als „Brightness“ (dt. „Helligkeit“) eines Fluorophors bezeichnet.
Die Quantenausbeute hängt intrinsisch von der molekularen Struktur des Farbstoffs ab, wird aber auch von zahlreichen äußeren Faktoren beeinflusst. Hierzu zählen u.a. Temperatur, Viskosität, Polarität und pH-Wert der Umgebung. Diese Umgebung kann aus Molekülen des Lösungsmittels und etwaigen Lösungsgenossen aber z.B. auch aus einem angekoppelten Biomolekül oder einer Zellmembran bestehen, in deren unmittelbarer Nachbarschaft sich der Fluoreszenzfarbstoff befindet. Durch die Veränderung der Fluoreszenz können also Rückschlüsse auf bestimmte Eigenschaften der Umgebung gezogen werden: Der Fluoreszenzfarbstoff wirkt dann quasi als molekulare Sonde.
Die Fluoreszenzquantenausbeute ist definiert als das Verhältnis der Anzahl der als Fluoreszenz emittierten Photonen (= Lichtquanten) zur Anzahl der von der Probe zuvor absorbierten Photonen:
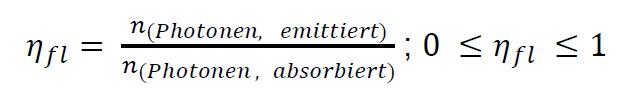
Werden alle absorbierten Photonen als Fluoreszenz abgestrahlt erhält man eine Quantenausbeute von 1 oder 100 %. Es konkurrieren aber immer auch strahlungslose Deaktivierungsprozesse des angeregten Zustands mit der Emission, so dass ein Teil der aufgenommenen Energie als Wärme in die Umgebung abgegeben wird.
Genau dieses Phänomen nutzt man bei der absoluten Bestimmung der Quantenausbeute über „kalorimetrische“ Methoden wie dem Thermal Blooming-Verfahren. Hierfür benötigt man relativ komplizierte Versuchsaufbauten sowie ein umfangreiches theoretisches Verständnis für die Konzeptionierung und Auswertung der Messungen.
Einfacher kann die unbekannte Quantenausbeute eines Fluorophors (Probe) durch den Vergleich mit der bekannten Quantenausbeute eines Standard- oder Referenzfarbstoffs (Referenz) in einem Fluoreszenzspektrometer ermittelt werden. Man kann diese so genannte Relativbestimmung auf verschiede Weise durchführen:
Die statistische Genauigkeit des Ergebnisses steigt mit der Anzahl an durchgeführten Vergleichsmessungen.
Die theoretische Voraussetzung für die Anwendung der Relativmethode ist, dass die beiden zu vergleichenden Lösungen von Probe und Referenz eine identische Absorption bei der Anregungswellenlänge besitzen und somit die gleiche Anzahl an Photonen absorbieren. Dann ergibt der Quotient der – unter identischen Bedingungen registrierten – integrierten Fluoreszenzspektren (IF = Fläche der Fluoreszenzbande) beider Lösungen das Verhältnis der Quantenausbeuten beider Farbstoffe, so dass die unbekannte Quantenausbeute leicht berechnet werden kann:
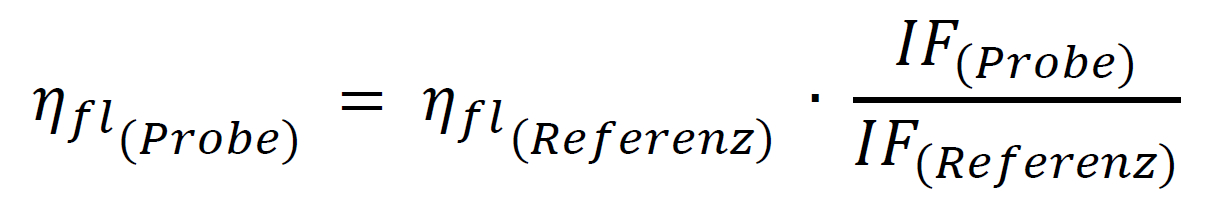
Wie wichtig es bei dieser Vergleichsmethode ist, jeweils das gesamte Fluoreszenzspektrum – die integrale Fluoreszenzintensität – von Probe und Referenz aufzunehmen, verdeutlicht das folgende Beispiel:
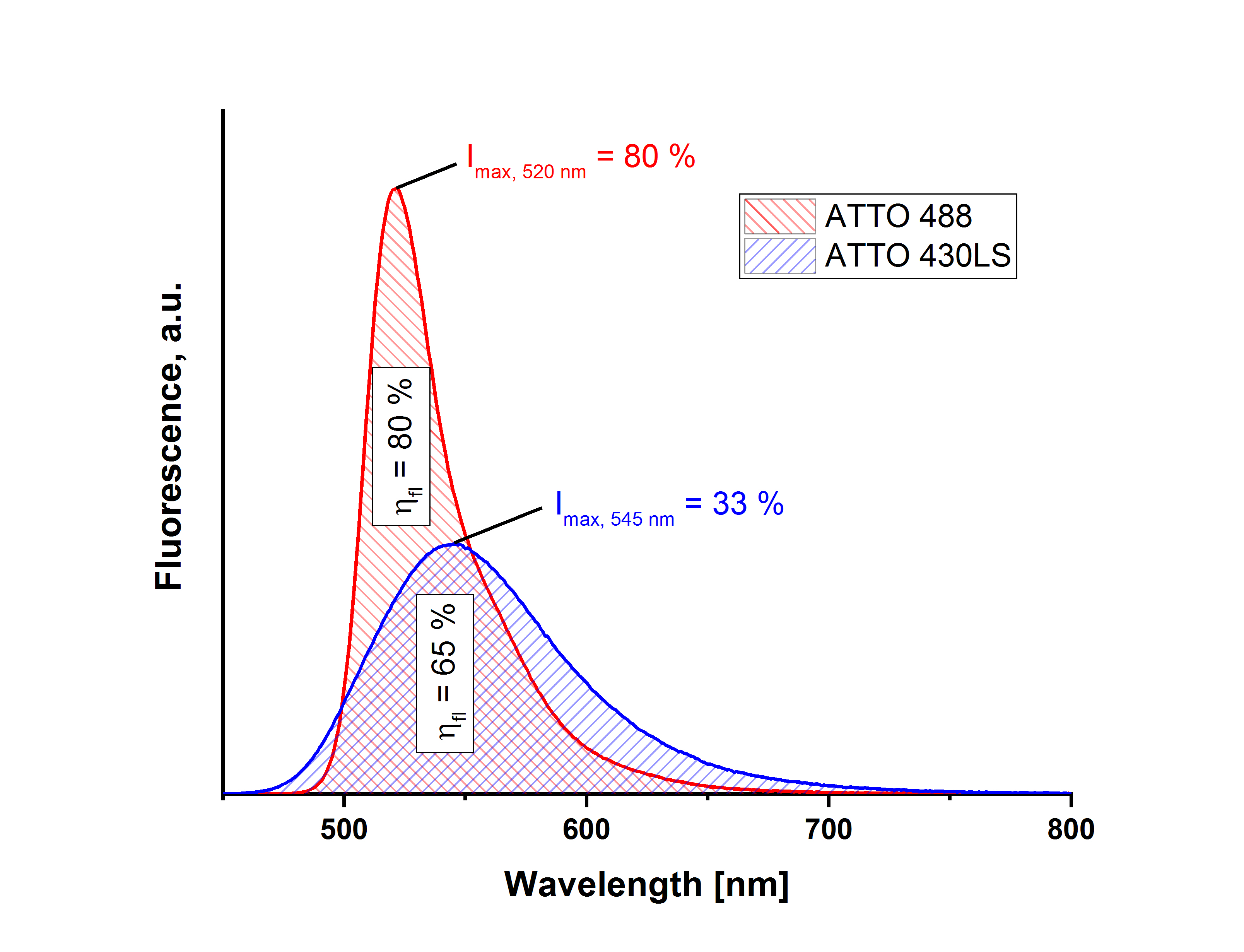
Die Farbstoffe ATTO 488 carboxy und ATTO 430LS carboxy wurden im Schnittpunkt der Absorptionsspektren (gleiche Absorption) angeregt und die Fluoreszenzspektren gemessen. Vergleichsmessungen mit einem Standard (Rhodamin 6G) ergaben eine Fluoreszenzquantenausbeute von 80 % für ATTO 488 carboxy. Mit diesem Wert erhält man nach der beschriebenen Relativmethode einen Wert von 65 % für ATTO 430LS carboxy. Würde man sich hingegen nur die Intensität am jeweiligen Fluoreszenzmaximum ansehen, käme man ausgehend von den bekannten 80 % für ATTO 488 carboxy nur noch auf 33 % für ATTO 430LS carboxy. Dieser starke Unterschied kommt durch die unterschiedlich breiten Fluoreszenzbanden, d.h. die unterschiedliche spektrale Verteilung der Fluoreszenz beider Farbstoffe zustande.
Identische Bedingungen für die Aufnahme der Fluoreszenzspektren von Probe und Referenz erreicht man von apparativer Seite durch die Verwendung der gleichen Messparameter. Hierzu zählen die Geometrie des Strahlengangs (z.B. 90 °- oder Front-Face-Anordnung), Detektorverstärkung (Gain), Spaltbreite (oder Bandpass) sowie die gleiche Anregungswellenlänge.
Als Anregungswellenlänge kann z.B. der Schnittpunkt der langwelligen Absorptionsbanden von Probe und Referenz gewählt werden. Die Absorption am jeweiligen Maximum der Farbstoffbande darf dann leicht unterschiedlich sein.
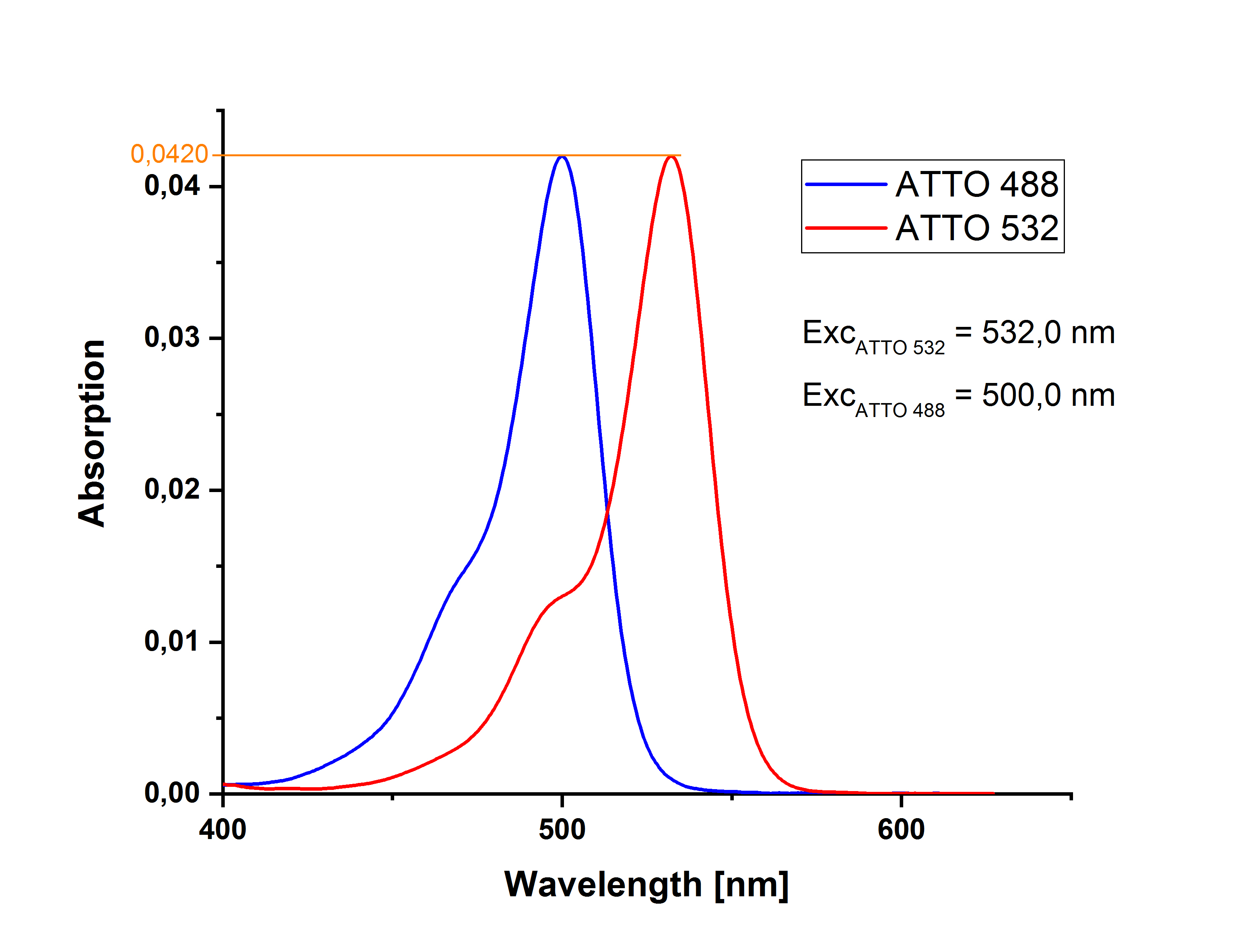
Am Beispiel von ATTO 488 carboxy und ATTO 532 carboxy mit leicht unterschiedlichen Extinktionswerten am jeweiligen Absorptionsmaxima wird dies deutlich: Nachdem man von beiden Messlösungen Absorptionsspektren aufgenommen hat, kann man durch das Übereinanderlegen der beiden Spektren den Schnittpunkt (hier 513.1 nm) bestimmen, an dem beide Lösungen die gleiche Extinktion (hier 0.0183) aufweisen. (Für kleine Werte sind Extinktion und Absorption identisch.)
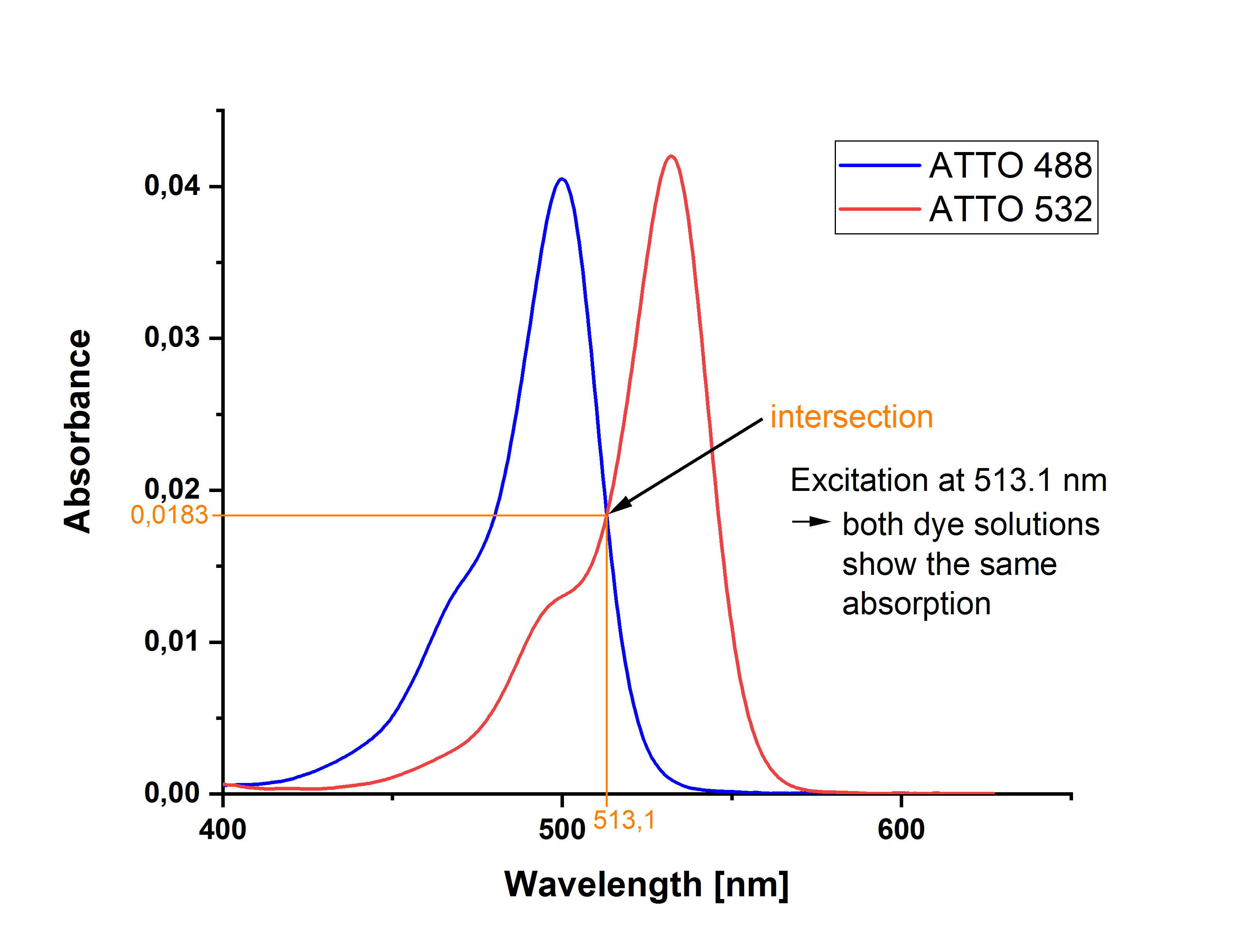
Wenn man sich hingegen für eine Anregung an den Absorptionsmaxima von Probe und Referenz entscheidet, müssen beide Lösungen bei der jeweiligen Wellenlänge exakt die gleiche Absorption aufweisen. Im gezeigten Beispiel lassen sich ATTO 488 carboxy bei 500 nm und ATTO 532 carboxy bei 532 nm anregen; beide Lösungen haben eine Extinktion von 0.0420.
In diesem Fall muss bei der Fluoreszenzmessung eine entsprechende Korrektur der unterschiedlichen Anregungsintensität bei den beiden Anregungswellenlängen durchgeführt werden. Dieser wellenlängenabhängige Intensitätsunterschied wird in modernen Fluoreszenzspektrometern standardmäßig mit einer Photodiode ermittelt, die zugleich auch zeitliche Intensitätsschwankungen der Anregungslichtquelle misst. Über die Gerätesoftware muss diese Korrektur während der Messung aktiviert sein, da sie nachträglich nicht mehr möglich ist.
Außerdem sollte der gewählte Messbereich das gesamte Fluoreszenzspektrum umfassen, d.h. die gemessene Intensität in der langwelligen Flanke sollte fast bis auf das Niveau des Detektorrauschens abgefallen sein.
Selbst wenn alle diese Voraussetzungen erfüllt werden, sind exakte Bestimmungen von Fluoreszenzquantenausbeuten in der Praxis sehr anspruchsvoll und erfordern eine gute Vorbereitung und sorgfältige Durchführung der Messung.
Hinweise zur Quantenausbeutemessung und auf mögliche Fehlerquellen
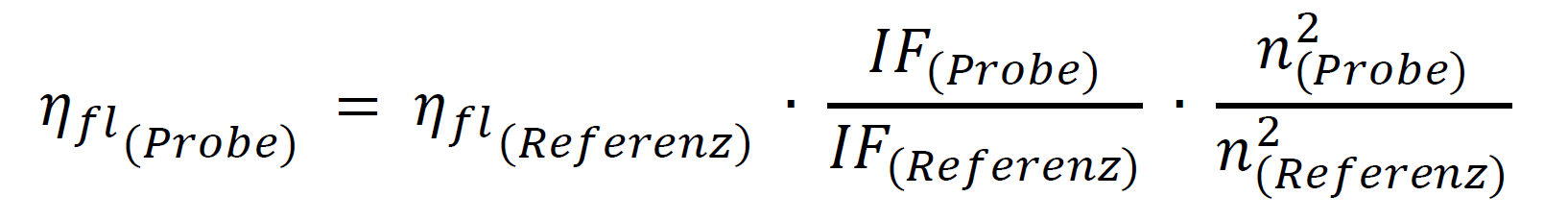
Viele Hersteller legen ihren Fluoreszenzspektrometern inzwischen genaue Anleitungen und Arbeitsvorschriften für die Messung der Fluoreszenzquantenausbeute bei, die auch von der jeweiligen Internetseite heruntergeladen werden können. Hier sind oftmals auch detaillierte Angaben und Hinweise zu den entsprechenden Geräteeinstellungen und Messparametern zu finden. Außerdem ist man auch von offizieller Seite bemüht, Methoden und Verfahren für Fluoreszenzstandards zu entwickeln.
Die von uns angegebenen Fluoreszenzspektren wurden mit dem Fluoreszenzspektrometer Fluorolog 3 von HORIBA Jobin Yvon gemessen. Dazu wurde für alle ATTO-Farbstoffe das jeweilige Carboxy-Derivat in wässriger Lösung (PBS, pH 7.4) bei 22 °C untersucht. Die Messungen wurden standardmäßig in der 90 °-Anordnung mit horizontaler Polarisation von Anregung und Emission durchgeführt. Zur Bestimmung der Fluoreszenzquantenausbeute der ATTO-Farbstoffe wurden Fluorophore mit anderweitig genau bestimmter Fluoreszenzquantenausbeute als Referenzfarbstoffe verwendet. Je nach Spektralbereich wurden hierfür z. B. Rhodamin 6G, Rhodamin 630 etc. eingesetzt.
Allgemeine Hinweise zur Fluoreszenzspektroskopie
Bei Absorptionsspektrometern kommen fast ausschließlich Zwei-Strahl-Geräte zum Einsatz, bei denen die Probelösung und eine Referenz (z.B. Küvette mit purem Lösungsmittel) „simultan“ abgetastet werden. Dadurch wird aus dem erhaltenen Spektrum die so genannte Gerätecharakteristik eliminiert, die aufgrund einer unterschiedlichen Transmission der Monochromatoren (Gitter, Spalte) und Reflexion an den Spiegeln u.a. für verschieden polarisiertes Licht und der spezifischen Detektorkennlinie gegeben ist.
Da ein solcher Referenzstrahlengang in der Fluoreszenzspektroskopie prinzipiell nicht vorhanden ist, muss die für jedes Fluoreszenzspektrometer in Abhängigkeit der optischen Bauteile und des Verlaufs des Strahlengangs unterschiedliche Gerätecharakteristik auf andere Weise berichtigt werden, um das „wahre“ Fluoreszenzspektrum einer Probe zu erhalten.
Bei modernen Fluoreszenzspektrometern enthält die Steuerungs- und Auswertesoftware hierzu üblicherweise eine so genannte Korrekturfunktion, mit der die gemessenen Gerätespektren entweder direkt bei der Messung oder durch die nachträgliche Anweisung des Benutzers korrigiert werden können. Diese Korrekturfunktion erstellt der Hersteller z.B. durch den Vergleich des mit dem betreffenden Gerät gemessenen und dem tatsächlichen Emissionsspektrum einer geeichten Lampe.
Abgesehen davon sollte bei jeder Fluoreszenzmessung noch ein anderes Phänomen bedacht werden. Hierbei handelt es sich um die Fluoreszenzpolarisation: Nur wenn sich die Fluorophore während der Lebensdauer des angeregten Zustands frei im Medium bewegen können erhält man unpolarisierte Fluoreszenz. In diesem Fall sind die Anteile an horizontal und vertikal polarisierter Fluoreszenz gleich groß.
Die freie Beweglichkeit wird beeinflusst durch die temperaturabhängige Viskosität des Lösungsmittels und das Molekülvolumen.
In gering viskosen Lösungsmitteln wie Aceton, Methanol, Ethanol und Wasser spielen solche Polarisationseffekte also bei kleinen organischen Fluorophoren mit einer Lebensdauer im Nanosekundenbereich bei Raumtemperaturmessungen gewöhnlich nur eine untergeordnete Rolle.
Wenn die Fluoreszenz von Probe und/oder Referenz aber aufgrund stark unterschiedlicher Moleküldimensionen und/oder Fluoreszenzlebensdauern nicht mehr unpolarisiert oder sogar verschieden polarisiert ist, kann dies zur Verfälschung der gemessenen Fluoreszenzspektren und damit zu einer falsch berechneten Quantenausbeute führen.
Um die Fluoreszenzpolarisation der Lösung eines Fluorophors zu ermitteln, gibt es ein relativ einfaches Verfahren, das man mit seiner theoretischen Herleitung und Erklärung bei J. R. Lakowicz findet.
Eine Untersuchung der Fluoreszenzpolarisation von an Makromoleküle (Polymere, Proteine, DNA etc.) angekoppelter Fluoreszenzmarker, deren freie Beweglichkeit während der Lebensdauer ihres angeregten Zustands eingeschränkt oder sogar unterbunden ist, kann – im Zusammenspiel mit der FRET-Technik – wichtige Erkenntnisse über die molekulare Struktur (Geometrie, Abstand, Orientierung) und damit zusammenhängende dynamische Phänomene liefern.
Literatur:
J. H. Brannon, D. Magde, Absolute Quantum Yield Determination by Thermal Blooming. Fluorescein, J. Phys. Chem. 82 705 (1978).
A.T.R. Willams, S.A. Winfiled, J.N. Miller, Relative Fluorescence Quantum Yields Using a Computer-controlled Lumniscence Spectrometer, Analyst 108, 1067 (1983).
J.R. Lakowicz, Principles of Fluorescence Spectroscopy, 3rd Edition, Springer Science+Business Media, New York (2006).
„A Guide to Recording Fluorescence Quantum Yields“, http://www.horiba.com/scientific
/products/fluorescence-spectroscopy/application-notes/quantum-yields/ (aufgerufen am 01.09.2017).
U. Resch-Genger, P.C. DeRose, Fluorescence standards: Classification, terminology, and recommendations on their selection, use, and production (IUPAC Technical Report), Pure Appl. Chem. 82, 2315 (2010).
Die Quantenausbeute hängt intrinsisch von der molekularen Struktur des Farbstoffs ab, wird aber auch von zahlreichen äußeren Faktoren beeinflusst. Hierzu zählen u.a. Temperatur, Viskosität, Polarität und pH-Wert der Umgebung. Diese Umgebung kann aus Molekülen des Lösungsmittels und etwaigen Lösungsgenossen aber z.B. auch aus einem angekoppelten Biomolekül oder einer Zellmembran bestehen, in deren unmittelbarer Nachbarschaft sich der Fluoreszenzfarbstoff befindet. Durch die Veränderung der Fluoreszenz können also Rückschlüsse auf bestimmte Eigenschaften der Umgebung gezogen werden: Der Fluoreszenzfarbstoff wirkt dann quasi als molekulare Sonde.
Die Fluoreszenzquantenausbeute ist definiert als das Verhältnis der Anzahl der als Fluoreszenz emittierten Photonen (= Lichtquanten) zur Anzahl der von der Probe zuvor absorbierten Photonen:
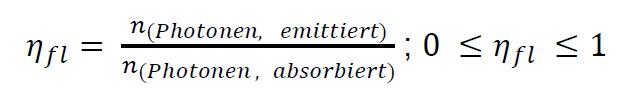
Werden alle absorbierten Photonen als Fluoreszenz abgestrahlt erhält man eine Quantenausbeute von 1 oder 100 %. Es konkurrieren aber immer auch strahlungslose Deaktivierungsprozesse des angeregten Zustands mit der Emission, so dass ein Teil der aufgenommenen Energie als Wärme in die Umgebung abgegeben wird.
Genau dieses Phänomen nutzt man bei der absoluten Bestimmung der Quantenausbeute über „kalorimetrische“ Methoden wie dem Thermal Blooming-Verfahren. Hierfür benötigt man relativ komplizierte Versuchsaufbauten sowie ein umfangreiches theoretisches Verständnis für die Konzeptionierung und Auswertung der Messungen.
Einfacher kann die unbekannte Quantenausbeute eines Fluorophors (Probe) durch den Vergleich mit der bekannten Quantenausbeute eines Standard- oder Referenzfarbstoffs (Referenz) in einem Fluoreszenzspektrometer ermittelt werden. Man kann diese so genannte Relativbestimmung auf verschiede Weise durchführen:
- Vergleich der Probe mit einem Referenzfarbstoff in einer Einzelmessung
- Vergleich der Probe mit mehreren Referenzfarbstoffe in mehreren Einzelmessungen
- Vergleich der Probe mit einem Referenzfarbstoff bei verschiedenen Konzentrationen und anschließende Auswertung der erhaltenen Messwerte.
Die statistische Genauigkeit des Ergebnisses steigt mit der Anzahl an durchgeführten Vergleichsmessungen.
Die theoretische Voraussetzung für die Anwendung der Relativmethode ist, dass die beiden zu vergleichenden Lösungen von Probe und Referenz eine identische Absorption bei der Anregungswellenlänge besitzen und somit die gleiche Anzahl an Photonen absorbieren. Dann ergibt der Quotient der – unter identischen Bedingungen registrierten – integrierten Fluoreszenzspektren (IF = Fläche der Fluoreszenzbande) beider Lösungen das Verhältnis der Quantenausbeuten beider Farbstoffe, so dass die unbekannte Quantenausbeute leicht berechnet werden kann:
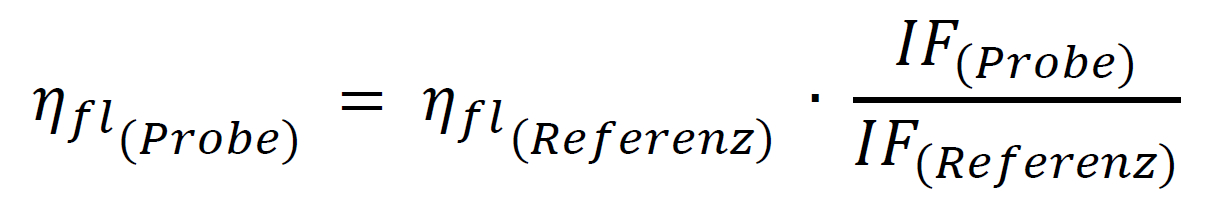
Wie wichtig es bei dieser Vergleichsmethode ist, jeweils das gesamte Fluoreszenzspektrum – die integrale Fluoreszenzintensität – von Probe und Referenz aufzunehmen, verdeutlicht das folgende Beispiel:

Die Farbstoffe ATTO 488 carboxy und ATTO 430LS carboxy wurden im Schnittpunkt der Absorptionsspektren (gleiche Absorption) angeregt und die Fluoreszenzspektren gemessen. Vergleichsmessungen mit einem Standard (Rhodamin 6G) ergaben eine Fluoreszenzquantenausbeute von 80 % für ATTO 488 carboxy. Mit diesem Wert erhält man nach der beschriebenen Relativmethode einen Wert von 65 % für ATTO 430LS carboxy. Würde man sich hingegen nur die Intensität am jeweiligen Fluoreszenzmaximum ansehen, käme man ausgehend von den bekannten 80 % für ATTO 488 carboxy nur noch auf 33 % für ATTO 430LS carboxy. Dieser starke Unterschied kommt durch die unterschiedlich breiten Fluoreszenzbanden, d.h. die unterschiedliche spektrale Verteilung der Fluoreszenz beider Farbstoffe zustande.
Identische Bedingungen für die Aufnahme der Fluoreszenzspektren von Probe und Referenz erreicht man von apparativer Seite durch die Verwendung der gleichen Messparameter. Hierzu zählen die Geometrie des Strahlengangs (z.B. 90 °- oder Front-Face-Anordnung), Detektorverstärkung (Gain), Spaltbreite (oder Bandpass) sowie die gleiche Anregungswellenlänge.
Als Anregungswellenlänge kann z.B. der Schnittpunkt der langwelligen Absorptionsbanden von Probe und Referenz gewählt werden. Die Absorption am jeweiligen Maximum der Farbstoffbande darf dann leicht unterschiedlich sein.
Am Beispiel von ATTO 488 carboxy und ATTO 532 carboxy mit leicht unterschiedlichen Extinktionswerten am jeweiligen Absorptionsmaxima wird dies deutlich: Nachdem man von beiden Messlösungen Absorptionsspektren aufgenommen hat, kann man durch das Übereinanderlegen der beiden Spektren den Schnittpunkt (hier 513.1 nm) bestimmen, an dem beide Lösungen die gleiche Extinktion (hier 0.0183) aufweisen. (Für kleine Werte sind Extinktion und Absorption identisch.)

Wenn man sich hingegen für eine Anregung an den Absorptionsmaxima von Probe und Referenz entscheidet, müssen beide Lösungen bei der jeweiligen Wellenlänge exakt die gleiche Absorption aufweisen. Im gezeigten Beispiel lassen sich ATTO 488 carboxy bei 500 nm und ATTO 532 carboxy bei 532 nm anregen; beide Lösungen haben eine Extinktion von 0.0420.

In diesem Fall muss bei der Fluoreszenzmessung eine entsprechende Korrektur der unterschiedlichen Anregungsintensität bei den beiden Anregungswellenlängen durchgeführt werden. Dieser wellenlängenabhängige Intensitätsunterschied wird in modernen Fluoreszenzspektrometern standardmäßig mit einer Photodiode ermittelt, die zugleich auch zeitliche Intensitätsschwankungen der Anregungslichtquelle misst. Über die Gerätesoftware muss diese Korrektur während der Messung aktiviert sein, da sie nachträglich nicht mehr möglich ist.
Außerdem sollte der gewählte Messbereich das gesamte Fluoreszenzspektrum umfassen, d.h. die gemessene Intensität in der langwelligen Flanke sollte fast bis auf das Niveau des Detektorrauschens abgefallen sein.
Selbst wenn alle diese Voraussetzungen erfüllt werden, sind exakte Bestimmungen von Fluoreszenzquantenausbeuten in der Praxis sehr anspruchsvoll und erfordern eine gute Vorbereitung und sorgfältige Durchführung der Messung.
Hinweise zur Quantenausbeutemessung und auf mögliche Fehlerquellen
- Der Referenzfarbstoff muss geeignet und seine Quantenausbeute hinreichend genau bekannt sein. Dies kann z.B. durch den Vergleich mit einer weiteren Referenz abgesichert werden.
- Der Referenzfarbstoff sollte so gewählt werden, dass er im gleichen Bereich absorbiert, d.h. angeregt werden kann, wie die Probe. Idealerweise überlappen sich die beiden Absorptionsspektren und es kann bei der Fluoreszenzmessung im Schnittpunkt beider Banden angeregt werden.
- Alle Glasgeräte und Küvetten müssen unbedingt absolut sauber gehalten werden.
- Die verwendeten Lösungsmittel sollten die Spezifikation „für die Spektroskopie“ besitzen und sollten auf ihre Eigenfluoreszenz hin untersucht werden.
- Sollen z.B. aufgrund von Löslichkeitsunterschieden verschiedene Lösungsmittel für Probe und Referenz verwendet werden, so muss dies durch die Einbeziehung der beiden Brechungsindizes n in die Berechnung berücksichtigt werden:
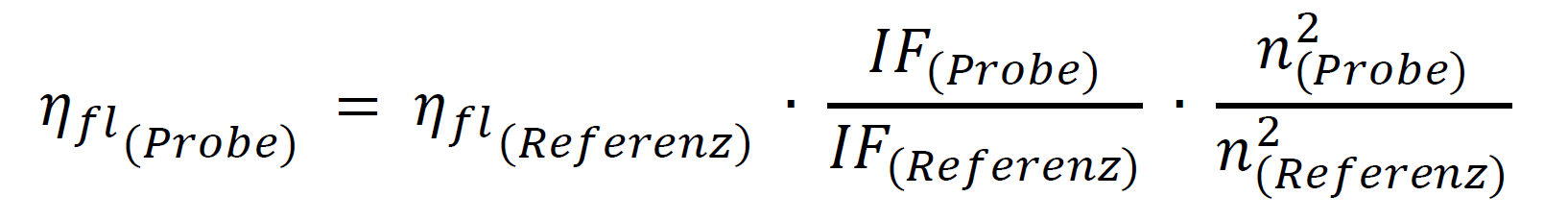
- Für die Fluoreszenzmessungen sollten Standard-Fluoreszenzküvetten mit einer optischen Weglänge von 10 mm verwendet werden.
- Um das Auftreten von Reabsorptionseffekten zu verringern, sollte die Extinktion in einer 10 mm-Zelle nicht über 0,05 liegen.
Bei höherer Konzentration können so genannte innere Filtereffekte auftreten, die die Fluoreszenzmessung stark verfälschen:
Einerseits dringt das Anregungslicht nicht mehr tief genug in die Lösung ein, was zu einer verminderten Anregung der Probe im Zentrum der Küvette führen kann.
Andererseits wird die von dort emittierte Fluoreszenz beim Durchgang durch die Lösung von sich im Strahlengang befindlichen weiteren Fluorophoren teilweise wieder (re-)absorbiert bevor sie die Küvette verlassen kann. Es resultiert dann ein im kurzwelligen Bereich abgeschnittenes Fluoreszenzspektrum. - Es ist darauf zu achten, dass die Basislinie der Absorptionsmessung nicht durch Lichtstreuung an ungelösten Partikeln oder schmutzigen Küvettenfenstern verfälscht wird.
- Solche Streuphänomene stören im Übrigen auch bei der Fluoreszenzmessung, da an Partikeln in der Lösung oder an der Küvettenoberfläche gestreutes Licht zum Detektor gelangen kann. Aus diesem Grund sollten die verwendeten Lösungsmittel und Lösungen vor der Messung µ-filtriert und die Küvettenfenster von außen mit einem fusselfreien Tuch abgewischt werden. Achtung: Fingerabdrücke!
- Die Messparameter der Fluoreszenzmessung (Gain, Spaltbreite) müssen an die Intensität der auftretenden Fluoreszenz angepasst werden, damit der verwendete Detektor (z.B. Photomultiplier) nicht durch eine zu hohe Lichtmenge beschädigt wird. Die Messung muss im linearen Bereich des Detektors stattfinden, denn nur dann ist die gemessene proportional zur eingestrahlten Lichtintensität.
- Man sollte sich des Einflusses der Temperatur auf die Messergebnisse bewusst sein.
Viele Hersteller legen ihren Fluoreszenzspektrometern inzwischen genaue Anleitungen und Arbeitsvorschriften für die Messung der Fluoreszenzquantenausbeute bei, die auch von der jeweiligen Internetseite heruntergeladen werden können. Hier sind oftmals auch detaillierte Angaben und Hinweise zu den entsprechenden Geräteeinstellungen und Messparametern zu finden. Außerdem ist man auch von offizieller Seite bemüht, Methoden und Verfahren für Fluoreszenzstandards zu entwickeln.
Die von uns angegebenen Fluoreszenzspektren wurden mit dem Fluoreszenzspektrometer Fluorolog 3 von HORIBA Jobin Yvon gemessen. Dazu wurde für alle ATTO-Farbstoffe das jeweilige Carboxy-Derivat in wässriger Lösung (PBS, pH 7.4) bei 22 °C untersucht. Die Messungen wurden standardmäßig in der 90 °-Anordnung mit horizontaler Polarisation von Anregung und Emission durchgeführt. Zur Bestimmung der Fluoreszenzquantenausbeute der ATTO-Farbstoffe wurden Fluorophore mit anderweitig genau bestimmter Fluoreszenzquantenausbeute als Referenzfarbstoffe verwendet. Je nach Spektralbereich wurden hierfür z. B. Rhodamin 6G, Rhodamin 630 etc. eingesetzt.
Allgemeine Hinweise zur Fluoreszenzspektroskopie
Bei Absorptionsspektrometern kommen fast ausschließlich Zwei-Strahl-Geräte zum Einsatz, bei denen die Probelösung und eine Referenz (z.B. Küvette mit purem Lösungsmittel) „simultan“ abgetastet werden. Dadurch wird aus dem erhaltenen Spektrum die so genannte Gerätecharakteristik eliminiert, die aufgrund einer unterschiedlichen Transmission der Monochromatoren (Gitter, Spalte) und Reflexion an den Spiegeln u.a. für verschieden polarisiertes Licht und der spezifischen Detektorkennlinie gegeben ist.
Da ein solcher Referenzstrahlengang in der Fluoreszenzspektroskopie prinzipiell nicht vorhanden ist, muss die für jedes Fluoreszenzspektrometer in Abhängigkeit der optischen Bauteile und des Verlaufs des Strahlengangs unterschiedliche Gerätecharakteristik auf andere Weise berichtigt werden, um das „wahre“ Fluoreszenzspektrum einer Probe zu erhalten.
Bei modernen Fluoreszenzspektrometern enthält die Steuerungs- und Auswertesoftware hierzu üblicherweise eine so genannte Korrekturfunktion, mit der die gemessenen Gerätespektren entweder direkt bei der Messung oder durch die nachträgliche Anweisung des Benutzers korrigiert werden können. Diese Korrekturfunktion erstellt der Hersteller z.B. durch den Vergleich des mit dem betreffenden Gerät gemessenen und dem tatsächlichen Emissionsspektrum einer geeichten Lampe.
Abgesehen davon sollte bei jeder Fluoreszenzmessung noch ein anderes Phänomen bedacht werden. Hierbei handelt es sich um die Fluoreszenzpolarisation: Nur wenn sich die Fluorophore während der Lebensdauer des angeregten Zustands frei im Medium bewegen können erhält man unpolarisierte Fluoreszenz. In diesem Fall sind die Anteile an horizontal und vertikal polarisierter Fluoreszenz gleich groß.
Die freie Beweglichkeit wird beeinflusst durch die temperaturabhängige Viskosität des Lösungsmittels und das Molekülvolumen.
In gering viskosen Lösungsmitteln wie Aceton, Methanol, Ethanol und Wasser spielen solche Polarisationseffekte also bei kleinen organischen Fluorophoren mit einer Lebensdauer im Nanosekundenbereich bei Raumtemperaturmessungen gewöhnlich nur eine untergeordnete Rolle.
Wenn die Fluoreszenz von Probe und/oder Referenz aber aufgrund stark unterschiedlicher Moleküldimensionen und/oder Fluoreszenzlebensdauern nicht mehr unpolarisiert oder sogar verschieden polarisiert ist, kann dies zur Verfälschung der gemessenen Fluoreszenzspektren und damit zu einer falsch berechneten Quantenausbeute führen.
Um die Fluoreszenzpolarisation der Lösung eines Fluorophors zu ermitteln, gibt es ein relativ einfaches Verfahren, das man mit seiner theoretischen Herleitung und Erklärung bei J. R. Lakowicz findet.
Eine Untersuchung der Fluoreszenzpolarisation von an Makromoleküle (Polymere, Proteine, DNA etc.) angekoppelter Fluoreszenzmarker, deren freie Beweglichkeit während der Lebensdauer ihres angeregten Zustands eingeschränkt oder sogar unterbunden ist, kann – im Zusammenspiel mit der FRET-Technik – wichtige Erkenntnisse über die molekulare Struktur (Geometrie, Abstand, Orientierung) und damit zusammenhängende dynamische Phänomene liefern.
Literatur:
J. H. Brannon, D. Magde, Absolute Quantum Yield Determination by Thermal Blooming. Fluorescein, J. Phys. Chem. 82 705 (1978).
A.T.R. Willams, S.A. Winfiled, J.N. Miller, Relative Fluorescence Quantum Yields Using a Computer-controlled Lumniscence Spectrometer, Analyst 108, 1067 (1983).
J.R. Lakowicz, Principles of Fluorescence Spectroscopy, 3rd Edition, Springer Science+Business Media, New York (2006).
„A Guide to Recording Fluorescence Quantum Yields“, http://www.horiba.com/scientific
/products/fluorescence-spectroscopy/application-notes/quantum-yields/ (aufgerufen am 01.09.2017).
U. Resch-Genger, P.C. DeRose, Fluorescence standards: Classification, terminology, and recommendations on their selection, use, and production (IUPAC Technical Report), Pure Appl. Chem. 82, 2315 (2010).
